认证种类GMP良好操作规范认证
服务内容GMP良好操作规范认证协助申请
所在地深圳&广州
GMP认证顾问GMP良好操作规范认证咨询
ISO22716认证咨询ISO22716良好操作规范体系内审员培训
GMP内审员培训良好操作规范体系内审员培训
GMP认证申请良好操作规范体系认证辅导
GMP认证种类GMP820认证&GMP110认证
GMP食品接触材料认证食品接触材料GMP认证
GMP认证辅导良好操作规范体系认证辅导
周期2个月左右
标准依据客户行业要求
审核流程协助推进
*一次性
GMP认证材料顾问协助整理
GMP认证资料咨询依据审核标准来
1. 目的
建立相应的体系,以限度的减少欺诈或参假食品原材的采购风险,而且确保所有的产品描述和承诺合法,准确且属实。
2. 适用范围
适用于本公司食品安全所涉及的所有供应商。
3.职责
采购部:对于所有供应商原材料索取相关资料。
采购部:对供应商原材料提供的检验报告进行核实验证。
4. 程序
4.1信息来源于:行业学会,来源,私有资源中心。
4.2对所有食品原材料或原材料组进行成文的脆弱评估,以评定或冒牌的潜在风险,考虑以下因素:
4.2.1掺假或冒牌的以往证据(主要参照《151种非法食品添加物》)
4.2.2掺假或冒牌更具吸引力的经济因素。
4.2.3通过供应商接触到原材料的难易程度。
4.2.4识别参加常规测试的复杂性。
4.2.5原材料的性质。应保持对薄弱性评估的审核,以反映潜在的风险对经济情况和市场情报的变化。应每年进行一次正式的审核。
薄弱性评估表如下:
评估规则:
a原物料特性:原物料本身特性是否*被掺假和替代。风险等级:高----*被掺假和替代;中----不易被掺假和替代;低----很难被掺假和替代。
b过往历史引用:在过去的历史中,在公司内外部,原物料有被掺假和替代的情况记录,风险等级:高----多次被掺假和替代的记录;中----数次被掺假和替代的纪录;低----几乎没有被掺假和替代的记录。
c经济驱动因素:掺假或替代能达成经济利益。风险等级:高----掺假或替代能达成很高的经济利益;中----掺假或替代能达成较高的经济利益;低----掺假或替代能达成较低的经济。
d供应链掌控度。通过供应链接触到原物料的难易程度:风险等级:高----较*接触到原物料中,在供应链中较难接触到原物料。
e识别程度:识别掺假常规测试的复杂性。
风险等级:高----无法通过常规测试方法鉴别出原物料的掺假和替代。中----鉴别出原物料的掺假和替代需要较复杂的测试方法,无法鉴别出低含量的参加和替代;低----较*和快速的鉴别出原物料的掺假和替代,检测精度高。
注:危害性:根据发生的可能性判定分值为1-6分,其中高风险划分有(*产生6分,较*产生5分);中风险划分有(一般产生4分,轻微产生3分);低风险划分有(基本不产生2分,不产生1分)
等级分数评判结果判定:
5-10分为低风险,可忽略不计的原料,不必采取下述行动,11-16分为中风险,不大可能掺原料有新的信息时要再评估,17-30分为高风险,较有可能掺原料,需要采取下述行动控制。
4.3在原材料被看作是掺假或冒牌的高风险的情况下,应制定相应的**措施或测试流程。
4.3.1采购要求供应商提供原材料担保书。
4.3.2每年提供一份第三方检测报。
4.3.3要求成品包装上贴有或取决于包括以下各项在原材料状态的标签或承诺声明包含以下内容:
4.3.3.1具体来源或原产地
4.3.3.2种植/变种承诺
4.3.3.3保证状态(如**良好农业规范)
4.3.3.4生物状态
4.3.3.5身份保持
4.3.3.6特定商标命名成分
5、对供应商生产方法作业承诺声明的情况下,我司有必要向供应商索取。
5.1销售配送记录,作业承诺声明的配送服务流程,并识别污染或身份丢失的区域,应建立适当的控制,以确保承诺声明的完整性。
5.2,部门近公布的易掺原料,应立即采取相应行动控制。
1.目的
规范公司质量食品安全管理体系文件的制订、审核、批准、发放、标识、更改、保管、回收和作废过程,确保体系文件的适宜性和有效性,且所有需要的场所都能获得需要的文件。使公司质量食品安全管理体系文件得以正确的流通和控制,保证各相关部门能够适时获得正确有效的文件。
2.范围
本程序适用于本公司质量食品安全管理体系文件的控制,包括手册、程序文件及作业书和与质量、食品安全、卫生管理有关的文件及技术性资料及相应的国际/国家法律、法规要求、外来文件等方面的管理。
3.职责:
3.1 总经理负责质量食品安全手册的批准。
3.2 管理者代表批准发布程序文件,并审核文件的发放范围。
3.3 品控部负责质量食品安全管理体系文件和资料的编制、修订、控制,控制文件编号等标识,维护公司《受控文件清单》。
3.4 品控部负责外来文件的收集及建档管理。
3.5 品控部负责所有对外资料的放行。
3.6 品控部负责有关技术性文件和资料的编制、修订。
3.7 各部门负责人负责:相关程序文件及作业书的制订、修改及审批;安排专人对文件进行接收、保管。
3.8 食品安全小组组长负责审核与食品安全有关的文件。

产品安全小组准备并提供:
1) 内、外部质量审核报告;
2) 不符合项报告表和纠正、预防措施的有关信息;
3) 对关键控制点的控制信息;
4) 产品质量的有关信息;
5) 加工线和布置状况的有关信息;
6) 程序文件和*三层次文件等;
7) 内外部信息交流结果;
8) 关键控制点验证结果。

1 对特定的产品应进行质量策划,策划的结果以适于公司运作的方式形成质量计划。
2 特定产品是指有下列情况的产品:
a) 在本公司生产的新产品;
b) 产品标准修订后技术要求变化较大;
c) 顾客对产品情况确定更严格的规定;
d) 依据实际情况对产品确定更严格的规定。
3 质量策划的内容
a)针对特定产品确定的质量食品安全目标;
b)针对特定产品所需建立的过程和子过程,应识别关键的过程和活动,对过程或涉及活动的途径,对这些途径进行评审并形成文件;
c)识别并提供上述过程所需的资源配置、运作阶段的划分、人员的职责权限和相互关系;
d)确定过程、CCP点或活动涉及的验证及验收准则;对CCP点、过程和产品的重要或关键特性,应安排测量和活动;对其中某些过程的输出应按输入的要求进行验证并确认;
e)确定为过程和产品的符合性提供证据所需要的记录。
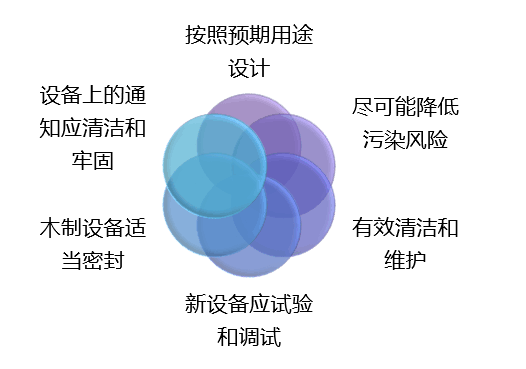
1外来文件的管理:
品控部负责主动收集公司所需的国际/国家标准、行业规范、法律法规等外来文件的有效版本,并对其进行编目、归档;外部提供给各部门的产品技术资料、检测报告、合格证书等外来资料,由品控部统一收集,记录在《外来文件登记表》,经管理者代表审核后,并根据需要统一发放。
2书面文件的使用:
2.1 现场使用的文件须置于现场,使用的文件由各部门管理。
2.2 使用部门不得影印正式发行之文件,文件不限制影印。
2.3 文件如有遗失破损,字迹模糊或份数不足等需要补发时,由需求部门填写《文件申请单》,原因,经部门负责人审查,管理者代表核准后予以补发,并于《文件发放/回收登记表》上进行记录。
2.4任何人不得于受控体系文件上加注标记或任何字符,并保持文件的清晰可辨。
质量体系记录
每一个制造商应保持一个质量体系记录(QSR)。QSR应包括(指出出处)本部分所要求的活动的程序和文件,这些活动不是针对类型的器械,包括但不局限于820.20所要求的记录。每一个制造商应确保QSR的制定和批准符合820.40的要求。
820.198抱怨文档
(a)每一个制造商应保持抱怨文档。每一个制造商应建立和保持程序以确保由的部门负责接收、评审和评价抱怨。这样的程序应确保:
(1) 适当地和及时地处理所有的抱怨;
(2) 受到口头抱怨时要及时记录;
(3) 要对抱怨进行评价以确定所抱怨的事件是否需要按照本章803和804的要求报告给FDA的的报告部门。
(b)要评审和评价所有的抱怨以确定是否有必要进行调查。当没有进行调查时,制造商应保持记录其中包括记录没进行调查的原因以及决定不进行调查的负责人的名字。
(c),除非已经调查过类似的抱怨,否则对任何有关器械故障、标签和包装对其规范的满足性的抱怨都应进行评审、评价和调查。
(d)如果按照本章803和804的要求,要由的人员对必须报告给FDA的抱怨事件进行快速的评审、评价和调查,并将该抱怨的文档单保存或做明显标识。除了820.198(e)所要求的信息,调查记录应确定以下问题:
(1) 器械是否没有满足规范
(2) 器械是否用来诊断或用
(3) 器械与所报告的不良事件有何关系
(e)当进行调查时,应由的部门保持调查记录,调查记录应包括:
(1) 器械的名称
(2) 收到抱怨的日期
(3) 所使用的器械的标识和控制码
(4) 抱怨人的联系电话、和姓名
(5) 抱怨的性质和细节
(6) 调查的日期和结果
(7) 所采取的纠正措施
(8) 对抱怨的回复
(f) 如果制造商的负责处理抱怨的部门不在生产场地,生产场地应能易于获得对抱怨的调查和调查的记录。
(g) 如果制造商的负责处理抱怨的部门不在美国,则本部分所要求的记录也应能在美国获得:
(1)在美国定期保持制造商记录的机构位置
(2)初始销售商的位置
http://iso9001fsc.b2b168.com




